мического союза на лекарственный препарат в случаях, предусмотренных подпунктами "а" - "в" пункта 34 Правил, если фактический уровень рентабельности за отчетный период, предусмотренный пунктом 40 Правил, превысит 30 процентов, заявляемая к перерегистрации предельная отпускная цена на лекарственный препарат подлежит снижению с учетом данного ограничения.
VI. Расчет средневзвешенной фактической цены ввоза лекарственного препарата иностранного производства в Российскую Федерацию
27. Расчет средневзвешенной фактической цены ввоза конкретного лекарственного препарата иностранного производства в Российскую Федерацию производится на основании сведений из системы мониторинга движения лекарственных препаратов для медицинского применения об объемах и ценах ввоза лекарственного препарата иностранного производства, находящегося в обращении на территории Российской Федерации.
При расчете средневзвешенной фактической цены ввоза лекарственного препарата учитываются сведения об объемах и о ценах ввоза лекарственного препарата за отчетный период, предусмотренный пунктами 26 и 40 Правил, по каждому иностранному производителю в рамках одного регистрационного удостоверения лекарственного препарата.
Расчет средневзвешенной фактической цены ввоза лекарственного препарата осуществляется с учетом формы выпуска (упаковки, комплектности) лекарственного препарата, за исключением случаев, предусмотренных пунктом 28 Правил.
28. Средневзвешенная фактическая цена ввоза лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия) , лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) иностранных производителей, указанных в регистрационном удостоверении лекарственного препарата, ввезенного за отчетный период, предусмотренный пунктом 26 Правил, на территорию Российской Федерации ( ) (рублей) , определяется по формуле:
) (рублей) , определяется по формуле:
 ,
,
где:
 - фактическая цена ввоза одной вторичной (потребительской) упаковки лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия) , лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) иностранного производства (рублей) ;
- фактическая цена ввоза одной вторичной (потребительской) упаковки лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия) , лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) иностранного производства (рублей) ;
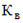 - количество вторичных (потребительских) упаковок лекарственного препарата иностранного производства (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия) , лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) , ввезенного иностранным производителем (импортером) на территорию Российской Федерации за отчетный период, предусмотренный пунктом 26 Правил, по одной цене (штук) ;
- количество вторичных (потребительских) упаковок лекарственного препарата иностранного производства (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия) , лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) , ввезенного иностранным производителем (импортером) на территорию Российской Федерации за отчетный период, предусмотренный пунктом 26 Правил, по одной цене (штук) ;
 - общее количество вторичных (потребительских) упаковок лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия) , лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) иностранных производителей в рамках регистрационного удостоверения лекарственного препарата, ввезенного иностранным производителем (импортером) на территорию Российской Федерации за отчетный период, предусмотренный пунктом 26 Правил (штук) .
- общее количество вторичных (потребительских) упаковок лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия) , лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) иностранных производителей в рамках регистрационного удостоверения лекарственного препарата, ввезенного иностранным производителем (импортером) на территорию Российской Федерации за отчетный период, предусмотренный пунктом 26 Правил (штук) .
Из общего количества ввезенного иностранным производителем (импортером) на территорию Российской Федерации объема лекарственных препаратов исключаются данные о ввозе лекарственных препаратов в рамках различных видов гуманитарной помощи и (или) в рамках благотворительности, данные о ввозе лекарственных препаратов с остаточным сроком годности менее 10 процентов, а также данные о ввозе лекарственных препаратов с фактической ценой ввоза, превышающей зарегистрированную предельную отпускную цену производителя.
VII. Расчет минимальной цены производителя на лекарственный препарат в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя
29. Расчет предельной отпускной цены производителя на лекарственный препарат (по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия) , лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) производится на основании сведений об уровне минимальных цен лекарственного препарата (без учета производственных площадок) в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя и на основании сведений, предусмотренных разделом III приложения № 4 к настоящей методике.
30. В разделе III приложения № 4 к настоящей методике минимальные цены производителя на лекарственный препарат в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя указываются в рублях. Пересчет цены в иностранной валюте в рубли осуществляется по среднему курсу соответствующей иностранной валюты к рублю Российской Федерации, установленному Центральным банком Российской Федерации за 3 календарных месяца, предшествующие месяцу даты подачи заявления о государственной регистрации (перерегистрации) предельной отпускной цены производителя на лекарственный препарат. Курс соответствующей иностранной валюты к рублю Российской Федерации, в соответствии с которым осуществлен пересчет цены в иностранной валюте в рубли, указывается в разделе IV приложения № 4 к настоящей методике.
31. В случае если лекарственный препарат реализуется в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя под другим торговым наименованием, в разделе III приложения № 4 к настоящей методике указываются соответствующее торговое наименование и минимальные цены производителя на лекарственный препарат.
32. В случае государственной регистрации (перерегистрации) в Российской Федерации предельной отпускной цены на лекарственный препарат с количеством лекарственного препарата во вторичной (потребительской) упаковке (количеством доз в упаковке, объемом) , отсутствующим в одном или нескольких иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя, в разделе III приложения № 4 к настоящей методике указываются минимальные цены на лекарственный препарат, в отношении которого заявляются к государственной регистрации (перерегистрации) предельные отпускные цены, с ближайшими по значению количествами лекарственного препарата во вторичной (потребительской) упаковке (вне зависимости от наличия их государственной регистрации на территории Российской Федерации) , которые реализуются в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя.
При этом минимальная цена производителя на заявляемый к государственной регистрации (перерегистрации) лекарственный препарат определяется как среднее арифметическое значение стоимости одной лекарственной формы лекарственных препаратов, имеющих ближайшие по значению количества лекарственного препарата во вторичной (потребительской) упаковке, умноженное на количество лекарственного препарата во вторичной (потребительской) упаковке заявляемого к государственной регистрации (перерегистрации) лекарственного препарата в каждом из иностранных государств, указанных в приложении № 3 к настоящей методике, и в стране производителя (графа 5 раздела III приложения № 4 к настоящей методике) .
В случае государственной регистрации (перерегистрации) в Российской Федерации предельной отпускной цены лекарственного препарата с дозировкой (концентрацией, активностью в единицах действия) , отсутствующей в одном или нескольких иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя, в разделе III приложения № 4 к настоящей методике указываются минимальные цены на заявляемый к государственной регистрации (перерегистрации) лекарственный препарат с ближайшими по значению дозировками (концентрациями, активностями в единицах действия) (вне зависимости от наличия их государственной регистрации на территории Российской Федерации) , которые реализуются в иностранных государствах, указанных в приложении № 3 к настоящей методике.
При этом минимальная цена производителя на заявляемый к государственной регистрации (перерегистрации) лекарственный препарат определяется как среднее арифметическое значение стоимости единицы действующего вещества лекарственных препаратов, имеющих ближайшие по значению дозировки (концентрации, активности в единицах действия) , умноженное на количество единиц действующего вещества заявляемого к государственной регистрации (перерегистрации) лекарственного препарата в каждом из иностранных государств, указанных в приложении № 3 к настоящей методике, и в стране производителя (графа 6 раздела III приложения № 4 к настоящей методике) . В расчете не учитываются ближайшие по значению дозировки (концентрации, активности в единицах действия) , превышающие дозировку (концентрации, активности в единицах действия) заявленного к государственной регистрации (перерегистрации) лекарственного препарата, предназначенного для применения в педиатрической практике (на основании сведений инструкции по медицинскому применению лекарственного препарата) , более чем в 2 раза.
33. В случае если лекарственный препарат иностранного производства или иностранного держателя или владельца регистрационного удостоверения лекарственного препарата, в том числе стадия производства готовой лекарственной формы которого и (или) стадия первичной и (или) вторичной упаковки которого осуществляются или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, производится только для продажи в Российской Федерации (не реализуется в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя) , для расчета предельной отпускной цены производителя на лекарственный препарат представляется информация о минимальных ценах других иностранных производителей на лекарственные препараты, отнесенные к одному международному непатентованному наименованию в такой же лекарственной форме (в том числе с учетом информации о взаимозаменяемых лекарственных препаратах для медицинского применения) , обращающиеся в государстве производителя, на основании данных из открытых общедоступных источников, соответствующих требованиям пункта 21 Правил. При этом заявленная к государственной регистрации цена на такой лекарственный препарат не должна превышать минимальную цену других иностранных производителей (с учетом расходов по уплате таможенных сборов за совершение таможенных операций, связанных с выпуском товаров) , рассчитанную на основании раздела III приложения № 4 к настоящей методике.
VIII. Расчет предельной отпускной цены производителей на лекарственный препарат производителя государства - члена Евразийского экономического союза при ее перерегистрации
34. Предельная отпускная цена на лекарственный препарат при ее перерегистрации устанавливается для каждого производителя в рамках регистрационного удостоверения лекарственного препарата в соответствии с требованиями пунктов 27, 28 и 32 Правил и не может превышать минимальную цену, рассчитанную в соответствии с настоящим разделом.
35. Перерегистрация предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат в случаях, предусмотренных подпунктами "а" - "в" пункта 34 Правил, осуществляется в соответствии с приложением № 8 к настоящей методике.
36. Предельная отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат при ее перерегистрации в случаях, указанных в подпунктах "а" и "в" пункта 34 Правил, подлежит увеличению:
а) на величину удорожания сырья и материалов;
б) на величину изменения накладных расходов.
37. Предельная отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат при ее перерегистрации в случае, указанном в подпункте "б" пункта 34 Правил, подлежит увеличению в части стоимости сырья и материалов, используемых при производстве конкретного лекарственного препарата, пропорционально величине удорожания стоимости сырья и материалов в структуре затрат на производство и реализацию лекарственного препарата, которое в равной степени влияет на зарегистрированные цены на все лекарственные препараты, отнесенные к одному международному непатентованному наименованию и имеющие одинаковый путь введения.
38. Величина увеличения зарегистрированной предельной отпускной цены на лекарственный препарат производителя государства - члена Евразийского экономического союза при ее перерегистрации в случаях, указанных в подпунктах "а" и "б" пункта 34 Правил, не должна превышать уровень фактической инфляции в предшествующем календарном году с учетом прогнозируемого уровня инфляции, установленного на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период (И) (процентов) , определяемый по формуле:
 ,
,
где:
 - индекс потребительских цен на товары и услуги предшествующего календарного года (процентов) ;
- индекс потребительских цен на товары и услуги предшествующего календарного года (процентов) ;
 - прогнозируемый уровень инфляции, установленный на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период (процентов) .
- прогнозируемый уровень инфляции, установленный на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период (процентов) .
39. При расчете предельной отпускной цены на лекарственный препарат при ее перерегистрации в случаях, указанных в подпунктах "а" - "в" пункта 34 Правил, не учитывается увеличение накладных расходов при изменении способа отнесения затрат организации, которые напрямую не связаны с основным производством, на себестоимость лекарственного препарата.
40. Перерегистрация предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат в случае, предусмотренном подпунктом "г" пункта 34 Правил, осуществляется на основании сведений, предусмотренных приложением № 2 к настоящей методике.
41. Предельная отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат подлежит перерегистрации в случае, указанном в подпункте "г" пункта 34 Правил, если средневзвешенная фактическая отпускная цена на лекарственный препарат за истекший период со дня принятия решения о государственной регистрации (перерегистрации) до дня подачи заявления о государственной перерегистрации была ниже зарегистрированной на этот период цены не более чем на прогнозируемый уровень инфляции, установленный на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период, но не выше величины, рассчитанной в соответствии с настоящей методикой.
42. Величина увеличения зарегистрированной предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат при ее перерегистрации в случае, указанном в подпункте "г" пункта 34 Правил ( ) (процентов) , с округлением до сотых определяется по формуле:
) (процентов) , с округлением до сотых определяется по формуле:
 ,
,
где:
 - коэффициент ценовой группы, определяемый в соответствии со значениями коэффициента ценовой группы, применяемого при расчете предельных отпускных цен производителей на лекарственные препараты, в отношении которых представляются на перерегистрацию предельные отпускные цены, согласно приложению № 9.
- коэффициент ценовой группы, определяемый в соответствии со значениями коэффициента ценовой группы, применяемого при расчете предельных отпускных цен производителей на лекарственные препараты, в отношении которых представляются на перерегистрацию предельные отпускные цены, согласно приложению № 9.
Ценовая группа определяется исходя из зарегистрированной предельной отпускной цены на лекарственный препарат за период, истекший со дня государственной регистрации (последней перерегистрации) ;
 - зарегистрированная предельная отпускная цена на лекарственный препарат за период, истекший со дня государственной регистрации (последней перерегистрации) (рублей) ;
- зарегистрированная предельная отпускная цена на лекарственный препарат за период, истекший со дня государственной регистрации (последней перерегистрации) (рублей) ;
 - средневзвешенная фактическая отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат, отгруженный производителем в адрес дистрибьюторов с целью последующей реализации за отчетный период, предусмотренный пунктом 40 Правил, рассчитанная в соответствии с разделом IV настоящей методики (рублей) .
- средневзвешенная фактическая отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат, отгруженный производителем в адрес дистрибьюторов с целью последующей реализации за отчетный период, предусмотренный пунктом 40 Правил, рассчитанная в соответствии с разделом IV настоящей методики (рублей) .
43. Предлагаемая к перерегистрации предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат не может превышать отпускную цену, рассчитанную в соответствии с настоящей методикой с учетом требований пункта 33 Правил.
44. Предлагаемая к перерегистрации предельная отпускная цена на лекарственный препарат, реализуемый в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя, не может превышать минимальную отпускную цену на этот же лекарственный препарат, определенную в соответствии с разделом VII настоящей методики на основании расчета, предусмотренного приложением № 4 к настоящей методике, с учетом расходов по уплате таможенных сборов за совершение таможенных операций, связанных с выпуском товаров.
IX. Расчет предельной отпускной цены на лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, при ее перерегистрации
45. Предельная отпускная цена на лекарственный препарат иностранного производства при ее перерегистрации устанавливается для каждого производителя в рамках регистрационного удостоверения лекарственного препарата в соответствии с требованиями пунктов 27, 28 и 32 Правил и не может превышать минимальную цену, рассчитанную в соответствии с настоящим разделом.
46. Перерегистрация предельной отпускной цены на лекарственный препарат иностранного производства осуществляется на основании:
а) обоснования расчета предельной отпускной цены на лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, представляемой на перерегистрацию, согласно приложению № 10 к настоящей методике;
б) сведений о средневзвешенной фактической цене ввоза лекарственного препарата иностранного производства, предусмотренных приложением № 10.
47. Перерегистрация предельной отпускной цены на лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, на лекарственный препарат осуществляется на основании:
а) сведений, предусмотренных приложением № 2 к настоящей методике;
б) обоснования расчета предельной отпускной цены на лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, представляемой на перерегистрацию, предусмотренного приложением № 10 к настоящей методике.
48. Предельная отпускная цена на лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, при ее перерегистрации подлежит увеличению при соблюдении следующих условий:
а) если рост курса национальной валюты каждого государства-производителя к