ния одних и тех же обязательных требований.
20. Обязательные профилактические визиты проводятся в отношении контролируемых лиц, приступивших в течение одного года, предшествующего принятию решения о проведении профилактического визита, к осуществлению деятельности в сфере производства лекарственных средств (контролируемых лиц, получивших лицензии, контролируемых лиц, в отношении которых внесены изменения в реестр лицензий в связи с осуществлением не предусмотренных в ранее действовавшей лицензии работ и услуг, составляющих деятельность по производству лекарственных средств, и (или) осуществлением деятельности по производству лекарственных средств по адресу, не указанному в реестре лицензий) .
Обязательный профилактический визит проводится в соответствии со статьей 52 Федерального закона "О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации" в рабочее время путем использования видео-конференц-связи в период, устанавливаемый уведомлением о проведении обязательного профилактического визита, и не может превышать 2 часа. При проведении обязательного профилактического визита должностными лицами лицензирующего органа осуществляется информирование контролируемого лица об обязательных требованиях, предъявляемых к осуществляемой им деятельности по производству лекарственных средств либо принадлежащим ему объектам лицензионного контроля, а также о видах, содержании и интенсивности контрольных мероприятий, проводимых в отношении объекта лицензионного контроля.
21. Целями проведения профилактических визитов являются:
а) предупреждение и сокращение количества нарушений контролируемыми лицами обязательных требований;
б) создание мотивации у контролируемых лиц к добросовестному поведению и, как следствие, снижение уровня ущерба охраняемым законом ценностям;
в) формирование единого понимания обязательных требований;
г) выявление причин, факторов и условий, способствующих нарушению обязательных требований, определение способов устранения или снижения рисков их возникновения.
22. По итогам завершения профилактического визита должностное лицо лицензирующего органа составляет акт проведения профилактического визита в 2 экземплярах, в котором указываются:
а) наименование лицензирующего органа;
б) наименование контролируемого лица;
в) дата, время и место составления акта профилактического визита;
г) реквизиты приказа, на основании которого проводился профилактический визит;
д) фамилии, имена, отчества (при наличии) , наименования должностей должностных лиц лицензирующего органа, проводивших профилактический визит;
е) дата, время, продолжительность и место проведения профилактического визита;
ж) перечень мероприятий, проведенных в ходе профилактического визита;
з) сведения о результатах проведения профилактического визита;
и) перечень прилагаемых документов и материалов (при наличии) ;
к) подписи должностных лиц лицензирующего органа, проводивших профилактический визит.
IV. Осуществление государственного лицензионного контроля
23. Лицензионный контроль осуществляется посредством проведения внеплановых контрольных мероприятий.
При проведении лицензионного контроля могут привлекаться не заинтересованные в результатах такой оценки специалисты в соответствии со статьей 34 Федерального закона "О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации".
24. Внеплановые контрольные мероприятия во взаимодействии с проверяемыми контролируемыми лицами осуществляются в следующих видах контрольных мероприятий:
а) документарная проверка;
б) выездная проверка.
25. Внеплановые контрольные мероприятия, указанные в пункте 24 настоящего Положения, проводятся в соответствии со статьями 57, 66, 72 и 73 Федерального закона "О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации".
26. В ходе документарной проверки в соответствии со статьями 72, 79 и 80 Федерального закона "О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации" могут совершаться следующие контрольные действия:
а) получение письменных объяснений;
б) истребование документов.
27. В ходе выездной проверки в соответствии со статьями 73, 76, 78 - 81, 83 и 84 Федерального закона "О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации" могут совершаться следующие контрольные действия:
а) осмотр;
б) опрос;
в) получение письменных объяснений;
г) истребование документов;
д) отбор проб и образцов;
е) испытание;
ж) экспертиза.
28. Срок проведения выездной проверки устанавливается в пределах 10 рабочих дней.
Срок проведения выездной проверки в отношении контролируемого лица, осуществляющего свою деятельность на территориях нескольких субъектов Российской Федерации, устанавливается отдельно по каждому филиалу, представительству, обособленному структурному подразделению организации или производственному объекту.
29. В случае выявления при проведении внепланового контрольного мероприятия нарушений лицензионных требований в отношении деятельности по производству лекарственных средств, установленных Положением о лицензировании производства лекарственных средств, утвержденным постановлением Правительства Российской Федерации от 6 июля 2012 г. № 686 "Об утверждении Положения о лицензировании производства лекарственных средств", лицензирующий орган в пределах полномочий обязан принять решения, предусмотренные частью 2 статьи 90 Федерального закона "О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации".
30. В случае отсутствия контролируемого лица или его представителя отбор проб (образцов) продукции (товаров) осуществляется с применением видеозаписи.
31. В целях проведения испытаний и экспертизы лекарственных средств на соответствие требованиям нормативной документации (нормативного документа по качеству) лицензирующий орган привлекает специалиста и (или) аккредитованные в соответствии с законодательством Российской Федерации об аккредитации в национальной системе аккредитации экспертную организацию или федеральные государственные бюджетные учреждения, подведомственные лицензирующему органу (далее - экспертная организация) .
32. Отбор проб (образцов) лекарственных средств осуществляется должностными лицами лицензирующего органа (территориального органа) в соответствии со своими должностными полномочиями.
33. Отбор проб (образцов) лекарственных средств для проведения испытаний экспертизы по всем или отдельным показателям нормативной документации (нормативного документа) осуществляется в количествах, необходимых для двукратного воспроизведения методов контроля качества лекарственного средства с учетом требований нормативной документации (нормативного документа) на него.
34. Для проведения испытаний и экспертизы методами неразрушающего анализа отбираются 3 упаковки лекарственного препарата или 10 граммов фармацевтической субстанции.
35. При совпадении спектров отобранных проб (образцов) лекарственных средств с эталонным спектром, установленным в соответствии с фармакопейными требованиями, отобранные пробы (образцы) лекарственных средств возвращаются контролируемому лицу, у которого они были отобраны для проведения экспертизы, с оформлением акта возврата образцов, форма которого утверждается лицензирующим органом.
36. При несовпадении спектра лекарственного средства с эталонным спектром осуществляется отбор проб (образцов) лекарственного средства для проведения экспертизы по показателям нормативной документации (нормативного документа) по качеству в соответствии с пунктами 37 и 38 настоящего Положения.
37. Пробы (образцы) лекарственных средств направляются лицензирующим органом (территориальным органом) в экспертную организацию с приложением копий протокола отбора проб (образцов) лекарственных средств.
38. Экспертиза осуществляется экспертом или экспертной организацией по поручению лицензирующего органа (территориального органа) на основании экспертного задания, которое может включать одну или несколько из следующих задач экспертизы:
а) установление фактов, обстоятельств;
б) установление тождества или различия;
в) установление объективных свойств и состояний имеющихся в наличии образцов лекарственных средств;
г) проведение оценки образца лекарственного средства на соответствие заданным критериям;
д) установление соответствия образца лекарственного средства требованиям нормативной документации (нормативного документа) .
39. Время осуществления экспертизы зависит от вида экспертизы и устанавливается индивидуально в каждом конкретном случае по соглашению между лицензирующим органом и экспертом или экспертной организацией.
40. Фотосъемка, аудио-, видеозапись осуществляются в следующем порядке:
а) для фиксации хода и результатов контрольного мероприятия осуществляются ориентирующая, обзорная, узловая и детальная фотосъемка и видеозапись;
б) фото-, аудио-, видеофиксация проводятся должностным лицом, уполномоченным на осуществление лицензионного контроля, при проведении контрольного мероприятия посредством использования фотоаппаратов, диктофонов, видеокамер, а также мобильных устройств (телефонов, смартфонов, планшетов) ;
в) оборудование, используемое для проведения фото- и видеофиксации, должно иметь техническую возможность отображения на фотоснимках и видеозаписи текущей даты и времени, а также сохранения данных о месте съемки (координат) ;
г) аудиозапись ведет должностное лицо, уполномоченное на осуществление лицензионного контроля, при проведении контрольного мероприятия;
д) при проведении фото- и видеофиксации:
необходимо применять приемы фиксации, при которых исключается возможность искажения свойств объекта контроля;
следует обеспечивать условия фиксации, при которых полученные фотоснимки, видеозапись максимально точно и полно отображают свойства объектов контроля;
е) информация о проведении фотосъемки, аудио- и видеозаписи отражается в акте контрольного мероприятия с указанием типа и марки оборудования, с помощью которого проводилась фиксация;
ж) фото-, аудио- и видеоматериалы являются приложением к акту контрольного мероприятия.
V. Ключевые показатели лицензионного контроля и их целевые значения
41. Ключевые показатели лицензионного контроля (КП) отражают уровень минимизации поступления недоброкачественных лекарственных средств в гражданский оборот.
Целевое значение ключевого показателя лицензионного контроля определяется исходя из ежегодного снижения на 1 процент.
Ключевой показатель лицензионного контроля (КП) определяется по формуле:
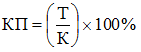 ,
,
где:
Т - количество отозванных серий лекарственных препаратов в связи с нарушением требований к производству лекарственных средств за отчетный период;
К - общее количество серий лекарственных препаратов, находящихся в обращении на территории Российской Федерации за отчетный период.
VI. Обжалование решений контрольных (надзорных) органов, действий (бездействия) их должностных лиц
42. Правом на обжалование решений Министерства промышленности и торговли Российской Федерации или Федеральной службы по ветеринарному и фитосанитарному надзору и ее территориальных органов, действий (бездействия) их должностных лиц обладает контролируемое лицо, в отношении которого приняты решения или совершены действия (бездействие) , указанные в части 4 статьи 40 Федерального закона "О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации".
43. Жалоба на решение Министерства промышленности и торговли Российской Федерации, действия (бездействие) его должностных лиц рассматривается руководителем Министерства промышленности и торговли Российской Федерации.
Жалоба на решение территориального органа Федеральной службы по ветеринарному и фитосанитарному надзору, действия (бездействие) его должностных лиц рассматривается руководителем (заместителем руководителя) указанного территориального органа Федеральной службы по ветеринарному и фитосанитарному надзору.
Жалоба на действия (бездействие) руководителя (заместителя руководителя) территориального органа Федеральной службы по ветеринарному и фитосанитарному надзору рассматривается Федеральной службой по ветеринарному и фитосанитарному надзору.
В случае обжалования решений центрального аппарата Федеральной службы по ветеринарному и фитосанитарному надзору и (или) действий (бездействия) ее должностных лиц жалоба рассматривается руководителем Федеральной службы по ветеринарному и фитосанитарному надзору.
Жалоба на решение, действия (бездействие) должностных лиц Министерства промышленности и торговли Российской Федерации или Федеральной службы по ветеринарному и фитосанитарному надзору и ее территориальных органов может быть подана в течение 30 календарных дней со дня, когда контролируемое лицо узнало или должно было узнать о нарушении своих прав.
44. Жалоба на предписание Министерства промышленности и торговли Российской Федерации или Федеральной службы по ветеринарному и фитосанитарному надзору Российской Федерации и ее территориальных органов может быть подана в течение 10 рабочих дней со дня получения контролируемым лицом предписания.
45. Жалоба, поступившая в Министерство промышленности и торговли Российской Федерации или Федеральную службу по ветеринарному и фитосанитарному надзору и ее территориальные органы, подлежит регистрации не позднее следующего рабочего дня со дня ее поступления. Жалоба рассматривается в течение 20 рабочих дней со дня ее регистрации.
При рассмотрении жалобы Министерство промышленности и торговли Российской Федерации или Федеральная служба по ветеринарному и фитосанитарному надзору и ее территориальные органы используют информационную систему досудебного обжалования контрольной деятельности.
46. В случаях, установленных частью 1 статьи 42 Федерального закона "О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации", уполномоченное должностное лицо Министерства промышленности и торговли Российской Федерации или уполномоченное лицо Федеральной службы по ветеринарному и фитосанитарному надзору и ее территориальных органов принимают решение об отказе в рассмотрении жалобы в течение 5 рабочих дней с момента получения жалобы.".
2. Пункт 135 перечня нормативных правовых актов и групп нормативных правовых актов Правительства Российской Федерации, нормативных правовых актов, отдельных положений нормативных правовых актов и групп нормативных правовых актов федеральных органов исполнительной власти, правовых актов, отдельных положений правовых актов, групп правовых актов исполнительных и распорядительных органов государственной власти РСФСР и Союза ССР, решений Государственной комиссии по радиочастотам, содержащих обязательные требования, в отношении которых не применяются положения частей 1, 2 и 3 статьи 15 Федерального закона "Об обязательных требованиях в Российской Федерации", утвержденного постановлением Правительства Российской Федерации от 31 декабря 2020 г. № 2467 "Об утверждении перечня нормативных правовых актов и групп нормативных правовых актов Правительства Российской Федерации, нормативных правовых актов, отдельных положений нормативных правовых актов и групп нормативных правовых актов федеральных органов исполнительной власти, правовых актов, отдельных положений правовых актов, групп правовых актов исполнительных и распорядительных органов государственной власти РСФСР и Союза ССР, решений Государственной комиссии по радиочастотам, содержащих обязательные требования, в отношении которых не применяются положения частей 1, 2 и 3 статьи 15 Федерального закона "Об обязательных требованиях в Российской Федерации" (Собрание законодательства Российской Федерации, 2021, № 2, ст. 471) , исключить.
____________